Hogyan lehet megtalálni a entalpiája reakció
Néhány kémiai reakciók elnyelik vagy bocsátanak meleg környezetben. Az ilyen közötti hőátadás a kémiai reakció, és a környezet, az úgynevezett entalpia, vagy H. azonban lehetetlen pontosan mérni a entalpiaváltozást számítanak ezért figyelembe környezeti hőmérséklet (jelöljük AH). AH azt jelzi, hogy egy kémiai reakció hő szabadul a környezetbe (exoterm reakció), vagy hőelnyelő (endoterm reakció). Entalpia kiszámítani: AH = m x s x ATm, ahol m - az a reagensek tömegére számítva, s - a fajhő, AT - hőmérséklet-különbség van.
lépések szerkesztése
1. módszer 3:
Kiszámítása entalpia szerkesztése
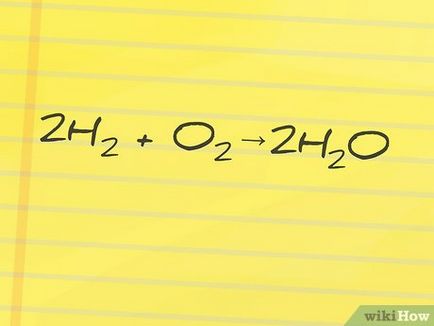
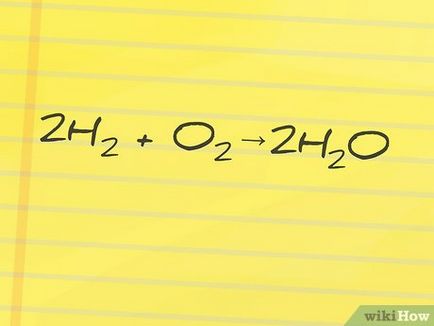
- Például, meg kell találni a entalpiája reakciót víz képződése oxigén- és hidrogén: 2H2 (hidrogén) + O2 (Oxygen) → 2H2 O (víz). Ebben a reakcióban, H2 és az O2 - ez Reagensek és H2 O - a termék a reakció.
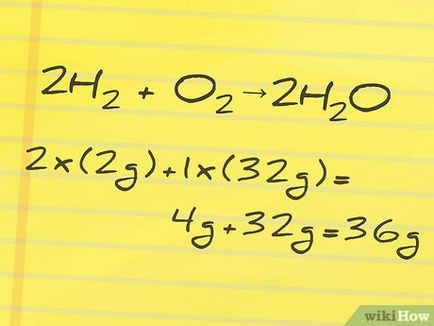
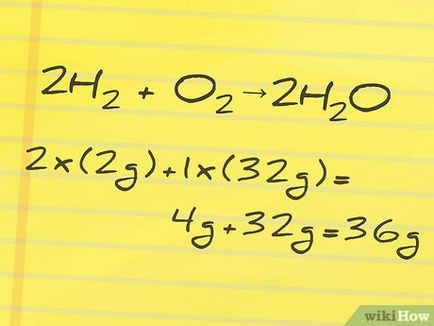
- A mi példánkban, a reagensek, a hidrogén és az oxigén, a molekulatömege 2 g és 32 g, ill. Mivel az általunk használt 2 mól hidrogén (az együttható egy kémiai reakció, mielőtt a hidrogén-H2) és 1 mól oxigén (hiányában az együttható O2 1 mol), a teljes tömeg a reagensek a következőképpen számítjuk ki:
2 × (2r) + 1 × (32g) = 4g + 32g = 36g
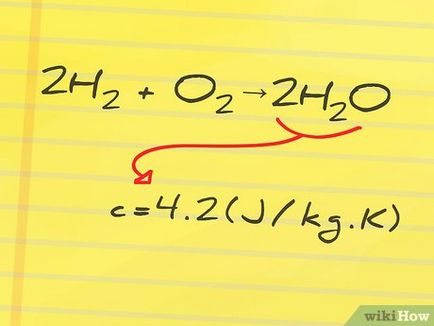
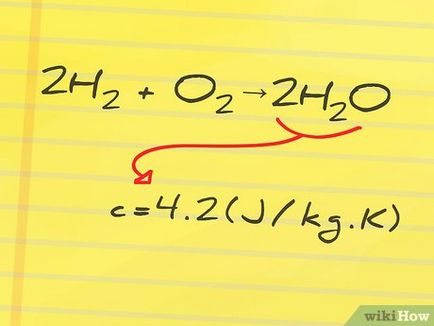
- Felhívjuk figyelmét, hogy ha több reakció termékeit, meg kell kiszámítani a hőkapacitása minden, majd adja hozzá őket, hogy entalpiája a reakciót.
- A mi példánkban, a reakcióterméket - a víz, amelynek fajhője 4,2 J / g ° C


- A mi példánkban, tételezzük fel, hogy a kezdeti reakció-hőmérséklet volt 185K, és 95K a reakció után kezdődött, ezért ,? T a következőképpen számítjuk ki:
AT = T2 - T1 = 95K - 185K = -90K


- A mi példánkban, entalpiája a következőképpen számítjuk ki:
AH = (36g) × (4,2 DzhK-1 g-1) × (-90K) = -13.608 J.


- A mi példánkban, a végső eredmény egyenlő -13.608 J. Mielőtt entalpia negatív érték, ami azt jelenti, hogy a reakció exoterm. Forró gáz (gőz) H2 és az O2 kell lefoglalni egy bizonyos mennyiségű hő alkotnak egy vízmolekula, vagyis H2 O képződése reakció exoterm.
2. módszer 3:
Kiszámítása entalpia szerkesztése


- Például, úgy a reakció: H2 + F2 → 2HF. Ebben az esetben az energia, hogy megtörjék a kötést a molekulában a H2 436 kJ / mol, és az energia rés F2 158 kJ / mól. [1] Végül a szükséges energia kötés képzésére egy molekulában HF H és F = -568 kJ / mól. [2] A közelmúltban, megszorozzuk az érték 2, mivel kapjunk a reakció során 2 mól HF, azaz 2 × -568 = -1136 kJ / mól. HKEY_LOCAL_MACHINE
436 + 158 + -1136 = -542 kJ / mól.


- Például, vegyük a következő reakcióban: C 2H 5OH + 3O2 → 2CO2 + 3H2 O. Tudjuk, hogy a entalpiája formáció számítjuk: [3]
C2 H5 OH → 2C + 3H2 + 0.5O2 = 228 kJ / mol
2C + 2O2 → 2CO2 = -394 × 2 = -788 kJ / mol
3H2 + 1,5 O2 → 3H2 O = -286 × 3 = -858 kJ / mol
Most adjuk hozzá a számokat a rokon anyagok fentiekben kapott, hogy meghatározzuk a entalpiája reakció: C 2H 5OH + 3O2 → 2CO2 + 3H2 O,
228 + -788 + -858 = -1418 kJ / mól.
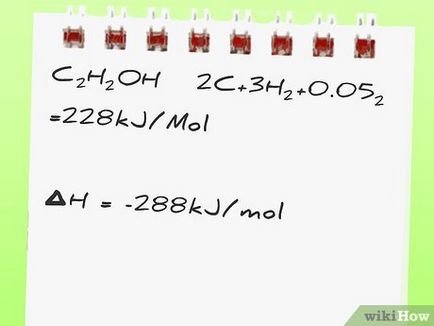

- A példában, vegye figyelembe, hogy a képződési reakciója C2 H5 OH terméket rögzített fordítva. C2 H5 OH → 2C + 3H2 + 0.5O2 azaz C2 H5 OH megtöri, ahelyett szintetizált. Ezért, a jel előtt a entalpia egy pozitív reakciót 228 kJ \ mol, bár a entalpiája képződésének C2 H5 OH -228 kJ \ mol.