Tárgy №6 «elektrokémiai eljárások”
Standardpotenciál fémek. Képződése kettős elektromos réteg és az elektród potenciál a fém-elektrolit határfelület. Nernst egyenlet.
Típusú elektródákkal. EMF a galvánelemek és maximális munkát. Redoxpotenciálok. Irány redox reakciók.
Elektrolízis elektrolit oldatok és megolvad. Az, hogy az oxidációs és redukciós az elektródákon. Elektrolízis Inert és oldható anód. Faraday-törvény. A jelenlegi hatékonyságát. bővítési potenciállal. A túlfeszültség.
A gyakorlati alkalmazása elektrokémiai folyamatok a szakterületen. Villamosenergia-források: galvanoelementy és akkumulátorok. A használata elektrolízis a szakterületen. Katódos és anódos folyamatokat.
Van egy nagyon szoros kapcsolat van a kémiai és elektromos jelenségek, kémiát, mert a legtöbb jelenség elektromos természetű. Az ilyen események közé tartozik, például, hidrogénkötés, hidratációs folyamatára ionizációs, egyesület, komplexképzéssel, és végül, az oxidációs-redukciós reakció.
Azonban ezek a folyamatok nem tulajdonítható számos elektrokémiai, mert nem kíséri egymásba az elektromos és kémiai energia. Például, ha a redox reakciót ugyanabban az oldatban, a rendszer nem termel elektromos munka, mivel a teljes áram miatt elektron transzfer a redukálószer, hogy az oxidálószer, nullával egyenlő (miatt kiszámíthatatlan mozgása elektronok és ionok).
Ha a katódos és anódos folyamatok térben oszlik (ahogy a cellában), majd lezárja a külső áramkörben, az elektronok napravlennoeperemeschenie az anód és a katód (vagyis az elektromos áram), és az oldatot végzett irányított mozgása az ionok a katód felől az anód.
Így, hogy csak azokat a elektrokémiai redox reakciókat okozó elektromos áram vagy magukat fordulnak elő hatása alatt az elektromos áram. Az első típusú reakciót elektrokémiai cellákban - miniatűr elemek és nagy teljesítményű akkumulátor elektromos járművek, a hidrogén üzemanyagcellák a villamos energia űrhajók - (amelyben a kémiai reakció energia alakul át elektromos energiává), a második típus - a elektrolizáló cellákban (, amelyekre a villamos energia alakul át kémiai ).
Standardpotenciál fémek.
1865-ben (azaz 4 évvel felfedezése előtt a törvény időszakos DI Mengyelejev) fémek sorolták aszerint, hogy azok aktivitását. Ez tette a híres magyar tudós NN Beketov, aki tanulmányozta a hatását a különböző fémek híg savakkal és vízzel, és észrevette, hogy a legtöbb aktívan viselkednek alkálifémek. Néhány ugyanazon fémek, mint például a Cu, Hg, Ag, Au, nem hidrogén eltolódik a savas oldatokat, éppen ellenkezőleg - maga képes, hogy kiszorítja a hidrogént a fém higany és az ezüst-sók.
Az eredmény a munkálatok NN Beketova nevezték elmozdulása körű fémek:
K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2. Cu, Hg, Ag, Au.
Minden fémek, bal felé ebben a sorban hidrogén kiszorítják hidrogén híg savak.
A modern neve a sorozat - „Elektrokémiai feszültség sorozat”, hiszen a helyzet az egyes fém ebben a sorozatban határozza meg az így nazyvaemogoelektrodnogo lehetséges.
Mi az elektródpotenciál? Hogyan történik?
Emlékezzünk chtoelektricheskim potentsialomnazyvayut összege megfelel az energiának, hogy kell fordított (majd pozitív potenciál), vagy amely beszerezhető (majd negatív potenciál) átcsoportosítási egységnyi villamos végtelenről egy adott pont.
Szerint jelen nézetek, a csomópontok a kristályrétegeiben fémek atomok és ionok, és semleges atomok nagyon kicsi, a túlnyomó többsége a részecskék formájában ionok. Elektronok betartása az kvantumelmélet, mozognak a területen a pozitív töltések, ami egyfajta „elektron gáz”. Tehát van egy dinamikus egyensúly fém, ami kifejezhető az alábbi egyenlettel.
Ha a fémlemezt vízbe merítik, majd az intézkedés alapján a poláros vízmolekulák része kationok bemegy egy folyékony Me Z + + MH2 O ↔ [Me (H2 O) m] z +. míg az elektronok maradnak a fémlemezt, aminek során a fém negatív töltésű.
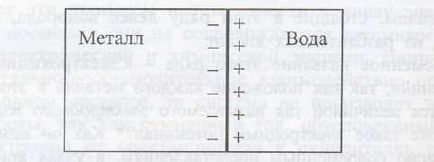
A kationok, hogy estek a folyékony, közelében van elhelyezve, a felület egy negatív töltésű fémlemez, ezáltal egy elektromos kettős réteg. amely sematikusan a következőképpen (1. ábra):
1. ábra. egy elektromos kettős réteg a fém-víz
Így, határán a folyékony fém villamos érintkezés potentsialφrezko változások és nablyudaetsyaskachok (vagy különbsége) potentsialaΔφ amely hozott nazyvatelektrodnym potenciál.
A legtöbb kortárs kémiai szakirodalom jelöljük prostoφ potenciális ugrik.
Nyilvánvaló, az aktívabb a fém, annál könnyebb lesz disszociálnak atomok, a több kation bemegy a folyadék, és így lesz bόlshim negatív töltés a fém, ami viszont okoz bόlshuyu potenciál-különbség a fém-folyadék határfelület.
A folyamat a átmenetifém-ionok a folyadék egy reverzibilis folyamat. Ezért, ha a fém lemez nem merítse a víz, és a fémsó-oldat, az egyensúly eltolódik: fém az oldat át kevesebb ionok és a potenciál-különbség a fém-oldat némileg eltérő, mint az első esetben.
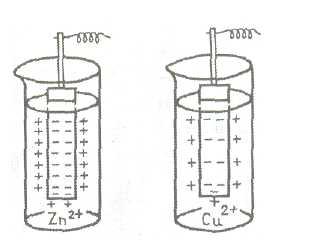
Ábra. A 2. ábrán az előfordulása az elektromos kettős réteg esetén a cink és réz lemezek, elmerül oldatok sóik.
2. ábra. Reakcióvázlat az elektród potenciál
Látható, hogy az érték az elektród potenciálja határozza meg elsősorban vsegoprirodoymetalla. Szintén ez függ a hőmérséklettől, a koncentrációtól és más megoldást faktorov1. Ezért összehasonlítani az elektród potenciál kell választani néhány szabványos körülmények között. Általában az összehasonlítást úgy végezzük 25 ° C hőmérsékleten, a nyomás 101,3 kPa és koncentrációban oldatban az azonos nevű ion egyenlő egy (1 mol / l).
Így a standardpotenciál nevezzük elektród potenciálját a fémion koncentráció 1 mól / l.
Az abszolút értéke az elektród potenciál nem mérhető (bevezetése óta minden próbák óhatatlanul kialakult egy új kapcsolatot a potenciális különbség). Azonban nincs nehéz otnositelnogoelektrodnogo mérése kapacitást.
Relatív fém elektród potenciál mérik egy standard hidrogén elektród potenciálját önkényesen nullának.
Mivel a hidrogén-hőmérsékleten 298 K ez egy gáz ebből lehetetlen, mint egy fémlemez gyártását. Mivel a szilárd inert fém (például Pt) használunk a standard hidrogén elektród.
Szerkezetileg hidrogén elektród (3.ábra) áll, egy platina-lemez réteggel bevont finomszemcsés platina - platinakorom, részben belemerül a savas oldatot egy hidrogén-ion-koncentráció 1 mol / l. Rendszerint nem illékony savat - kénsav H2 SO4 vagy perklórsav HCIO4. A lemez szolgál a tiszta hidrogéngáz állandó 101,3 kPa nyomást.
A megjelenése a kapacitást a standard hidrogén elektród lehet az alábbi képlettel ábrázolható. A hidrogén-gáz adszorbeálódik platina belép atomi állapotban azonban a felületi réteg platina kiegyenlítődni H2 ↔ 2H, de határán a platina és kénsav - egyensúlyt H ↔ H + + e.
A teljes folyamatot alábbi egyenlet fejezi ki:
Így a hidrogén elektród lehet kijelölni H2 / H +, Pt. ahol a függőleges vonal jelzi a fázishatár.
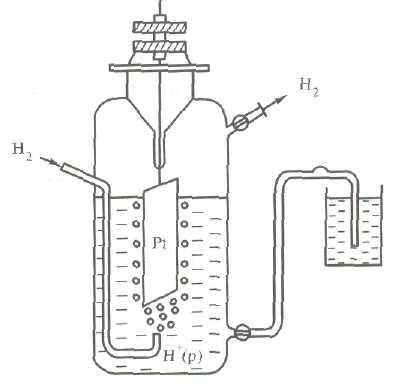
Ábra. 3. reakcióvázlat hidrogén elektród, vagy úgy
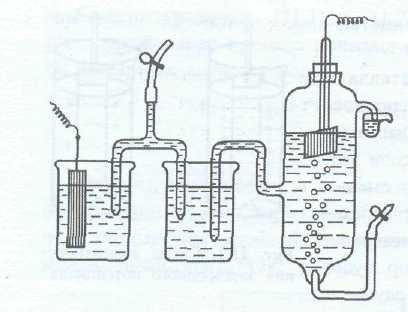
Ha egy fémlemezt merítjük sóoldat koncentrációja a fémion a 1 mol / l, hogy csatlakoztassa a elektrolit híd egy hidrogén elektród (3), kapjuk az elektrokémiai cellát. azaz az eredő elektromos áram megy rendszert. miatt raznostyuelektrodnyhpotentsialovvodorodnogoelektrodai izuchaemogometalla.
Hogy ez az érték - a különbség az elektród potenciálja az anód és a katód - a nyitott (oldva) nevű galvánelem elektromotoros erő (EMF vagy E) az elem:
A zamknutomgalvanicheskom elem. azaz amikor a mért érték az áram az elem (azaz, amikor a platina fém vegyület néhány fémes vezetőt), a potenciális különbség a katód és az anód feszültség nevezik:
Közvetlen mérése a potenciális különbség a terminálok az elektrokémiai cella egy hagyományos voltmérő tudja szerezni az értéke az U feszültség, amely nem egyenlő a EMF elemnek, vagyis U<ЭДС.
A különbség a elektromotoros erő és a feszültség miatt a feszültségesés az elemen belül áramot engedünk (a fizika EMF = I · R + I · rvnutr .. ahol rvnutr - Amikor a belső ellenállása az elektródák I.
0 termék I · rvnutr .. = 0, de a kifejezés az R I · bár nagyon kicsi, de ennek ellenére még mindig és EMF). Ezért mérése EMF kompenzációs módszer általában végzett, amelyben az átfolyó áram elem közel nulla. Egy egyszerűbb és kevésbé pontos mérésére alkalmas módszert az elektromotoros erő közvetlen mérése a kapocsfeszültség az elektrokémiai cella egy feszültségmérővel, amelynek nagy ellenállású (nagy ohmos voltmérő). Mivel a nagy ellenállás voltmérő kis átfolyó áram az elem, így nem sok különbség a elektromotoros erő és a cella feszültsége.
EMF mérő áramkör, amely egy standard hidrogén elektród és a standard elektród potenciálját a fém elektrodayavlyaetsya utóbbi.
Ha megmérjük a standardpotenciál különböző fémek viszonyítva a standard hidrogén elektród potenciálját, és gondoskodik azok növekvő sorrendben, akkor megkapjuk a számos fémek feszültségek:
Számos stressz jellemzi a kémiai tulajdonságai fémek:
A kisebb méretű a algebrai φ0 fémet, így kémiailag aktív. azaz A nagyobb rugalmasságát.
A további távközre vannak egy sor két fém stressz, a bόlshuyu elektromotoros erő épül ezekből elektrokémiai cellában, ahol a katód mindig az elektród potenciál nagyobb.