Entalpia vonatkoztatási rendszer
Termodinamikai módszerekkel lehetetlen, hogy az abszolút értékek entalpia és a belső energia, és csak akkor lehet meghatározni, hogy megváltoztassa őket. Ugyanakkor, a termodinamikai számítások a kémiailag reagáló rendszerekben a használata kényelmes, egyetlen referencia rendszer. Itt, mivel az entalpia és a belső energia egymással. elegendő rendszer bevezetése referencia az egyik entalpia. Továbbá, az összehasonlítás és rendelés a hőhatás kémiai reakciók, amelyek függnek a fizikai állapot, a reagensek és átszivárogtatására XP feltételek, a koncepció a standard halmazállapot. Szerint a Bizottság ajánlása a termodinamika az IUPAC (IUPAC) 1975-ben, a standard állapot meghatározása a következő:
„A standard reakciókörülmények a feltétele gázok hipotetikus ideális gáz nyomáson 1 fizikai atmoszféra (101325 Pa). A szilárd anyagok és folyadékok a standard állapot olyan állapot a tiszta folyadékra vagy tiszta, kristályos anyag, illetve nyomáson 1fizicheskuyu atmoszférában. Az anyagok megoldások a hipotetikus szabványos állapotban elfogadott állapot, amelyben a moláris entalpiája oldatot (1 mol anyag 1 kg oldószer) egyenlő lenne a entalpiája oldatot végtelen hígítás. Az anyagok tulajdonságainak standard körülmények által kijelölt felső index 0”. (Tiszta anyag nevezett anyag egyféle strukturális részecskék (atomok, molekulák stb)).
Ez a meghatározás az említett hipotetikus gáz feltételek és oldott anyag, mert a tényleges gáz állapotban, hogy kisebb vagy nagyobb mértékben eltér az ideális és állapotát megoldások - egy ideális megoldás. Ezért, ha a termodinamikai tulajdonságai anyagok standard körülmények között úgy korrigálják, hogy tényleges körülményeket eltérést ezen tulajdonságok a tényleges. Ha ezek az eltérések kicsik, így a módosítás nem lép.
A termodinamikai értékek könyvtárak általában szokásos körülmények között: nyomás p = 0 101325Pa és a hőmérséklet T0 = T0 = 0 K vagy 298,15K (25 0 C-on). Létrehozásakor táblázatok komplett entalpiákat anyagok, mint a referencia entalpia azt is elfogadott standard állapotára hőmérsékleten T0 = T0 = 0 K vagy 298,15K.
Mi anyagokat. Tiszta kémiai elemek vannak a leginkább stabil fázis állapotban p = 0 101325Pa, és a hőmérséklet T0 a származási entalpiák. az értéke entalpiája nulla. . (Például, anyagok gáz halmazállapotú: O2 N2 H2 Cl2 F2 stb C (grafit) és a fém (szilárd kristály) .....).
A kémiai vegyületek (CO2. H2 O, stb), és az olyan anyagok, amelyek, hogy egy tiszta kémiai elemek, amelyek nem a legstabilabb állapotban (O, N és mtsai.) Entalpia ha p = 0, és 101325Pa T0ne nulla. .
Entalpiája kémiai vegyületek, amikor p 0, és a T0 egyenlőre van beállítva a termikus hatás kialakulásának a tiszta kémiai elemek ezeket a paramétereket, azaz a . Például, a T0 = 0 K: és T0 = 298,15K :.
A entalpiája bármely olyan hőmérsékleten T megegyezik a hőmennyiség, amely szükséges ahhoz, hogy a izobár folyamat, hogy tisztítsa ki a kémiai elemek hőmérsékleten T0, hogy megkapja az anyag, és melegítsük, hogy a hőmérséklet T0, azaz a hőmérséklet T. számítási képlete entalpiája bármely anyag formájában:
. vagy mi a karcsúbb felvétel:
ahol a felső indexbe „o” azt jelzi, hogy az anyag standard állapotban p = 0 101325Pa; - képződését entalpiája anyag hőmérséklete T0 a tiszta kémiai elemek; = - feleslegben entalpia kapcsolódó hőkapacitása az anyag, - a teljes entalpiáját, figyelembe véve az entalpia az anyag.
Reakcióvázlat entalpia T hőmérsékleten úgy reprezentálható, mint:
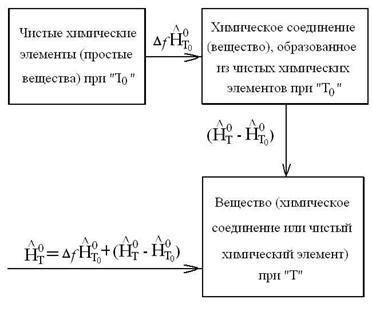
Az utalás a különböző egyes anyagok kerülnek bemutatásra mennyiségeket, és a felesleges entalpia különböző hőmérsékleteken Tc.
Mivel a felesleges entalpiája az egyes anyagok a táblázatokban nem kapnak, majd a bal oldalon a kifejezés a T0 = 298,15K szükséges hozzá, és vonjuk képződéshő anyag hőmérsékleten T0 = 0K. Ezután megkapjuk a felesleges entalpia. amely tartalmazza a táblák, és a további távon. egyenlő a különbség képződéshő hőmérsékleten T0 = 298 K és T0 = 0 K; azaz . Aztán ott van:
Teljes entalpia kiszámításra kapcsolatok a T0 és T0 = 0 K = 298,15K azonos számértéket anyaggal egy adott hőmérsékleten T.